Fenotipo pigmentario
last update: 22 agosto 2009
Sommario
I principali geni della pigmentazione.
Biogenesi dei melanosomi.
Biochimica della sintesi della melanina.
Regolazione della melanogenesi.
Abbronzatura.
Materiale didattico
Bibliografia
Sommario
L’analisi delle mutazioni del colore del mantello murino ha fornito molte informazioni sulla genetica e la biologia della pigmentazione umana.L’apparato biochimico necessario alla produzione della melanina si trova nei melanociti, confinato all’interno di organelli delimitati da membrana, detti melanosomi.
La melanosomogenesi avviene in 4 stadi morfologicamente distinti, attraverso una via endosomale/melanosomale/lisosomale ancora non completamente chiara, portando alla formazione di eumelanosomi, contenenti un pigmento nero-marrone, l’eumelanina, o feomelanosomi, contenenti un pigmento rosso-giallo, la feomelanina.
Il flusso melanogenico è regolato da: enzimi melanogenici (tirosinasi, TRP1, TRP2), disponibilità di substrato, cationi metallici bivalenti, attivatori ed inibitori, endogeni ai melanociti, ed altri fattori di regolazione. La tirosinasi controlla la reazione limitante (idrossilazione dell’L-tirosina a DOPA), gli altri determinanti melanogenici controllano la qualità e la quantità di melanina formata. A partire da un amminoacido, la tirosina, per azione dell’enzima tirosinasi, attraverso la formazione di dopa, dopachinone, leucodopacromo, dopacromo, 5,6-diidrossiindolo (decarbossilato e/o carbossilato), indolo5,6-chinone (non carbossilato e/o carbossilato) e polimerizzazione di quest’ultimo, si formano le eumelanine. In una via alternativa, il dopachinone reagisce con la cisteina per formare cisteinildopa, che successivamente viene ossidata a cisteinilchinone; questo ciclizza formando la benzotiazina, la cui polimerizzazione dà origine alle feomelanine e ai tricocromi.Durante il processo di maturazione (melanosomogenesi e melanogenesi), i melanosomi si spostano dalla regione perinucleare ai processi dendritici dei melanociti, lungo binari microtubulari, con l’ausilio di diverse proteine, tra cui Rab27a e MiosinaVa, che, dai microtubuli, li trasferiscono sui filamenti di actina delle estremità dendritiche, dove vengono trattenuti, per poi essere, eventualmente, trasferiti ai cheratinociti.
I melanociti epidermici e follicolari riversano i loro melanosomi nei cheratinociti circostanti, rispettivamente dell’epidermide e degli assi piliferi nascenti, dove vengono degradati e ridistribuiti, conferendo alla cute e ai capelli un determinato colore
I diversi e distinti modelli di distribuzione melanosomale ( numero, dimensioni ed impacchettamento dei melanosomi nei cheratinociti ) sono presenti alla nascita e rappresentano, insieme al grado di melanizzazione e alle differenze chimiche nei pigmenti melanici (proporzione DHI/DHICA-eumelanine e feomelanine/eumelanine: mixed-melanina), i fattori determinanti la gradazione visibile del colore della cute e dei capelli nella specie umana, mentre il numero e la distribuzione dei melanociti sono essenzialmente costanti.
I melanociti oculari uveali che danno il colore alla corioide e all’iride, trattengono i loro melanosomi all’interno del citoplasma (lo stesso accade per i melanociti oculari retinici).La regolazione subcellulare della melanogenesi (il flusso della via biosintetica, in relazione all’ambiente melanosomale) è coordinata ed integrata da una più complessa regolazione cellulare, la quale si avvale di svariati fattori, che esercitano il loro controllo a livello trascrizionale, traduzionale e post-traduzionale, positivamente o negativamente, disponendosi in sequenze non lineari, bensì in una rete multidimensionale, in cui agiscono ed interagiscono in un modo nonrandon, determinato dal contesto genetico-biochimico-fisico. Risultato finale di tale “fine tuning” è il livello basale costitutivo della melanogenesi: continua nei melanociti epidermici, ciclica nei melanociti follicolari, quasi assente, dopo lo sviluppo fetale, nei melanociti oculari.
Un ruolo positivo nella regolazione della melanogenesi (tipo e grado di melanizzazione), a livello trascrizionale, è svolto nell’uomo, come nel topo, dal sistema “recettore MC1R-agonisti αMSH/ACTH”, attraverso la via del cAMP.Un ruolo negativo nella regolazione della melanogenesi è sicuramente assunto, nel topo, dalla proteina del segnale aguti (ASP), che ostacola, antagonizzando i peptidi melanocortini, la via eumelanogenica, inibendo leggermente l’espressione e l’attività della tirosinasi, e quasi totalmente l’espressione e l’attività delle altre proteine melanosomali e di MC1R, e induce lo switching eumelanina→feomelanina. Il suo ruolo nella pigmentazione umana non è ancora chiaro, anche se nei melanociti umani coltivati, ASP inibisce la sintesi dell’eumelanina e l’attività della tirosinasi, e riduce il livello di espressione di TRP1 e tirosinasi.In condizioni fisiologiche, le radiazioni ultraviolette (UV) della luce solare, agendo, sia direttamente che indirettamente, sui melanociti, stimolano la melanogenesi, determinando un inscurimento della cute, la cosiddetta abbronzatura, che gioca un ruolo fotoprotettivo chiave contro gli effetti carcinogeni degli UV.
I principali geni della pigmentazione.
L’analisi delle mutazioni del colore del mantello murinoha fornito molte informazioni sulla genetica e la biologia della pigmentazione umana. Sono stati descritti più di 85 loci genici, mutazioni a livello dei quali alterano la pigmentazione, e sono stati isolati i trascritti e le sequenze geniche di circa il 25% di essi, per ognuno dei quali è stato trovato un gene analogo ed altamente omologo espresso nei melanociti umani, il che suggerisce che i prodotti di questi geni hanno un ruolo cruciale nel processo della pigmentazione. Essi agiscono come enzimi, proteine strutturali, regolatori trascrizionali, trasportatori, recettori e fattori di crescita.
La tabella 1 presenta alcuni geni murini della pigmentazione e i loro omologhi umani, l’analisi dei quali si propone di tracciare le linee guida del processo che porta alla formazione, al trasporto e alla distribuzione della melanina, come determinante del colore della cute, dei capelli e dell’uvea oculare.
Tabella 1. I geni della pigmentazione.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Da King, 2001 (modificata-R. Pellegrino 2007)
Biogenesi dei melanosomi: eumelanosomi e feomelanosomi.
L’apparato biochimico necessario alla produzione della melanina si trova nei melanociti, confinato all’interno di organelli delimitati da membrana, detti melanosomi, la cui integrità serve a minimizzare gli effetti citotossici di molti intermedi nella via biosintetica della melanina.
I melanosomi si originano dal Reticolo Endoplasmatico, come vescicole citoplasmatiche delimitate da una membrana liscia e con un interno amorfo. A questo stadio gli organelli, detti premelanosomi I, non contengono alcun enzima melanogenico richiesto per la sintesi della melanina, ma solo componenti strutturali, quali le proteine P e PMEL17, e possono procedere verso l’ eumelanosomogenesi o la feomelanosomogenesi.
Durante la formazione degli eumelanosomi maturi, grandi (circa 0,9 x 0,3 µm) ed ellissoidali, con pigmenti eumelanici di colore nero e/o marrone, su una matrice glicoproteica fibrillare, altamente ordinata,gli enzimi melanogenici (tirosinasi,TYR; proteina 1 correlata alla tirosinasi, TYRP1; proteina 2 correlata alla tirosinasi, TYRP2), sintetizzati sui ribosomi e trasportati attraverso il Reticolo Endoplasmatico Ruvido all’Apparato del Golgi, dove continua il processamento post-traduzionale, vengono secreti dalla faccia trans-Golgiana, nell’ambiente citoplasmatico, racchiusi all’interno di vescicole rivestite, che, trasportate ai premelanosomi I, si fondono con la membrana limitante, formando gli eumelanosomi II, con una matrice interna ben organizzata, ma ancora priva di melanina. E’ a questo punto che inizia la deposizione uniforme della melanina sulla matrice interna degli organelli ( eumelanosomi III). La tirosinasi, cataliticamente competente fin dal suo percorso attraverso il Golgi, diviene cataliticamente attiva, attraverso un processo in cui forse entra in gioco l’inattivazione di inibitori melanogenici probabilmente presenti, e l’opacità degli organelli aumenta gradualmente, fino a che l’intera struttura interna è completamente oscurata dalla melanina matura, densa agli elettroni (eumelanosomi IV). (fig. 1., a-f).
Durante la formazione dei feomelanosomi maturi, più piccoli ( circa 0,7 µm) e sferici, con pigmenti feomelanici di colore rosso e/o giallo, su una matrice glicoproteica vescicologlobulare, poco aggregata e disordinata, la tirosinasi, il solo enzima melanogenico richiesto, sempre racchiusa in vescicole rivestite provenienti dalla rete transgolgiana, confluisce ai premelanosomi I ed è già attiva allo stadio II, anche se ad un livello comparativamente inferiore che negli eumelanosomi. Accanto a questa attività enzimatica è richiesta la disponibilità di cisteina. (fig. 2.4, g-j). (Slominski, 20003; Sturm, 2001).
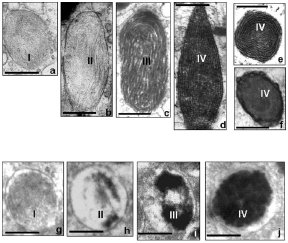
Fig. 1. Melanosomogenesi.
Sviluppo dei melanosomi durante l’eumelanosomogenesi (a - f) e la feomelanosomogenesi (g – j) nei melanociti normali. Spiegazione nel testo. Da Slominski, 2003.
Un secondo modello (Kushimoto,2001) indica che il sistema AP-3 (proteina adattatrice 3), legandosi ai motivi dileucina, presenti a livello delle code citoplasmatiche delle proteine enzimatiche melanogeniche TYRPs, le trasporta dalla rete transgolgiana agli endosomi primitivi, e di qui agli endosomi tardivi, che poi si fondono con i premelanosomi, tracciando una via biogenetica comune melanosomi-lisosomi. La stessa sequenza di smistamento è probabilmente seguita da altre due proteine melanosomali, MART1 e OA1.
Gli enzimi melanogenici, incorporati nei premelanosomi I, sono tagliati dalle proteasi endogene, perdendo la loro funzione catalitica, mentre il taglio a carico della proteina PMEL17 determina un cambio conformazionale, da una forma legata alla membrana ad una libera, che le consente, come proteina della matrice melanosomale, di dare alla struttura melanosomale interna un aspetto fibrillare ( stadio II). E’ a questo punto che gli enzimi melanogenici diventano resistenti alla proteolisi e la sintesi della melanina ha inizio ( stadio III). Lo stadio III e lo stadio IV dei melanosomi sono distinguibili solo sulla base dell’estensione della melanina depositata sulla matrice fibrillare. (fig. 2).
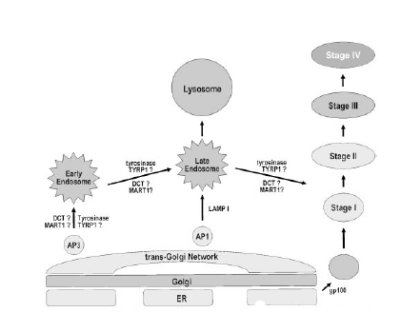
Fig. 2.a. Biogenesi melanosomi/lisosomi - modello due -
Modello per la biogenesi dei melanosomi e per la localizzazione delle proteine.Sono illustrate le principali tappe della biogenesi degli endosomi/lisosomi/melanosomi.Da Kushimoto, 2001.
Secondo un modello più recente (Raposo, 2007), i melanosomi primitivi deriverebbero da domini vacuolari di endosomi primitivi e la loro progressiva maturazione richiederebbe una distribuzione sequenziale e temporale del carico melanosomale da parte di distinti domini tubulari endosomali.
Il dominio vacuolare degli endosomi primitivi fornirebbe il carico richiesto per la struttura melanosomale di base (PMEL). Distinti domini tubulari degli endosomi primitivi fornirebbero successivamente gli altri carichi (compresi gli enzimi melanogenici). Il processo nel suo insieme ha ancora molti punti non chiari, tra cui la coordinazione tra le diverse vie, le vie seguite da altri componenti melanosomali e la funzione svolta , lungo queste vie, dai complessi, che sono difettosi nelle sindromi di Hermansky-Pudlak (fig. 2b)
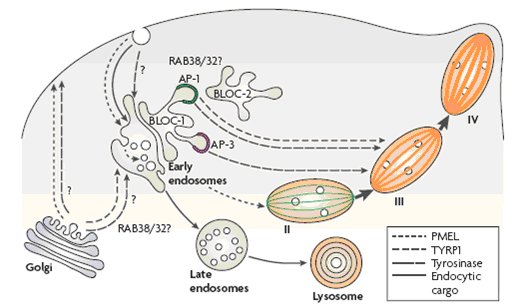
Fig. 2.b. Biogenesi dei melanosomi/endosomi/lisosomi -modello tre -
Spiegazione nel testo
Da Raposo, 2007
Durante il processo di maturazione i melanosomi si spostano dalla regione perinucleare ai processi dendritici dei melanociti, lungo binari microtubulari, con l’ausilio di diverse proteine, tra cui Rab27a e MiosinaVa, che, dai microtubuli, li trasferiscono sui filamenti di actina delle estremità dendritiche, dove vengono trattenuti, per poi essere, eventualmente, trasferiti ai cheratinociti .
I melanociti epidermici (fig.3)e follicolari (fig.4) sono secretori, per cui riversano i loro melanosomi nei cheratinociti circostanti, rispettivamente dell’epidermide e degli assi piliferi nascenti, mediante un meccanismo non ancora ben caratterizzato ( fagocitosi, endocitosi, trasferimento fisico dei melanosomi attraverso un gap di comunicazione intercellulare o inoculazione diretta nei cheratinociti). Trasferiti nei cheratinociti, i melanosomi vengono degradati e ridistribuiti, conferendo alla cute e ai capelli un determinato colore. In generale, la cute più scura contiene numerosi grandi melanosomi, mentre la cute più leggermente pigmentata contiene melanosomi più piccoli e meno densi, racchiusi in gruppi delimitati da membrana. I diversi e distinti modelli di distribuzione melanosomale ( numero, dimensioni ed impacchettamento dei melanosomi nei cheratinociti ) sono presenti alla nascita e non sono determinati dall’esposizione al sole. Essi rappresentano, insieme al grado di melanizzazione e alle differenze chimiche nei pigmenti melanici (proporzione DHI/DHICA-eumelanine e feomelanine/eumelanine), i fattori determinanti la gradazione visibile del colore della cute e dei capelli nella specie umana, mentre il numero e la distribuzione dei melanociti sono essenzialmente costanti.
I melanociti oculari uveali , che danno il colore alla corioide e all’iride, non secernono i loro melanosomi, ma li trattengono all’interno del citoplasma (fig.5).
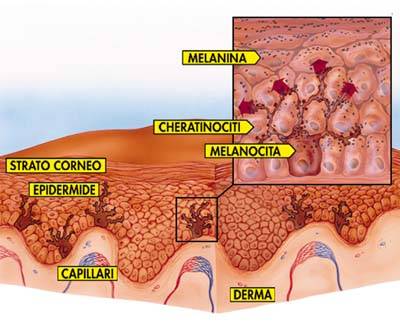
I melanociti risiedono, come cellule dendritiche sparse, nello strato basale dell’epidermide. Dal corpo cellulare di ognuno di essi si dipartono processi citoplasmatici che si insinuano tra i cheratinociti dello strato malpighiano (strato basale e strato spinoso), ai quali vengono ceduti i melanosomi. La cute è colorata per la presenza di pigmento nello strato malpighiano, mentre lo strato corneo è incolore e trasparente perché la melanina degenera e scompare al momento della cheratinizzazione massiva.
Da G. Bartoli, 2004.
Fig. 4. Peli e melanociti follicolari (momentaneamente non disponibile).
I melanociti, localizzati nello strato basale del bulbo pilifero, intorno all’apice della papilla dermica, con la quale (attraverso una sottile lamina basale) interagiscono, trasferiscono i melanosomi ai vicini cheratinociti precorticali, che andranno a formare l’asse pilifero pigmentato, come cheratinociti corticali, nei quali la melanina viene solo minimamente digerita.
Fig. 5. Uvea oculare e melanociti oculari uveali (momentaneamente non disponibile).
Biochimica della sintesi della melanina. .
I melanosomi maturi, dunque, non sono altro che granuli di melanina, delimitati da membrana.
In vitro, in un tubo test, contenente tirosina o DOPA e tirosinasi, la via di sintesi della melanina, fatta eccezione per le prime due tappe, procede spontaneamente, ad una velocità variabile in relazione alle concentrazioni di ossigeno e di ioni idrogeno presenti. L’enzima tirosinasi ha un ruolo critico nella formazione della melanina, poiché è necessario per la catalisi delle prime due reazioni: l’idrossilazione dell’L-tirosina a L-3,4-diidrossifenilalanina (DOPA) e l’ossidazione di DOPA a DOPAchinone (Prove recenti indicano che dall’idrossilazione della tirosina si formi direttamente il DOPAchinone). Dato che l’idrossilazione spontanea della tirosina è trascurabile, questa prima reazione rappresenta la tappa rate-limiting nella via biosintetica. Una volta che si è formato il DOPAchinone, la sintesi della melanina procede spontaneamente, senza ulteriori interventi catalitici, attraverso una serie di reazioni di ossidoriduzione e trasformazioni intramolecolari. Il DOPAchinone ciclizza spontaneamente formando un anello indolico che si ritrova nel leucoDOPAcromo, che a sua volta si converte in DOPAcromo. Quest’ultimo perde spontaneamente un gruppo carbossilico producendo il 5,6-diidrossiindolo (DHI), che ossida rapidamente a indolo-5,6-chinone, la polimerizzazione del quale produce un polimero omogeneo, la melanina.
In vivo concorrono a regolarne il flusso altri enzimi melanogenici, oltre all’indispensabile tirosinasi, disponibilità di substrato, cationi metallici bivalenti, attivatori ed inibitori, endogeni ai melanociti, ed altri fattori di regolazione.La tirosinasi controlla la reazione limitante, gli altri determinanti melanogenici controllano la qualità e la quantità di melanina formata (fig. 6).
La struttura chimica del biopolimero melanico , che poco si presta all’analisi strutturale secondo i metodi chimici convenzionali, date le sue insolite proprietà e l’instabilità dei suoi intermedi, è ancora sotto indagine. E’ però chiaro che in natura è più eterogeneo, con subunità rappresentate da tutti i derivati ciclici del DOPAchinone, compreso forse il DOPAchinone stesso, ed è classificabile in due tipi fondamentali: le eumelanine, nere e/o marroni, derivanti dai metaboliti del DOPAcromo, e le feomelanine, rosse e/o gialle, derivanti dai metaboliti del cisteinilDOPA (che si forma dal DOPAchinone , in presenza di gruppi sulfidrilici).
Nei melanociti umani si ritrova generalmente una mixed-melanina, biopolimero formato da una miscela di eumelanine e feomelanine in diverse proporzioni.
La tirosina è il substrato melanogenico con il quale ha tradizionalmente inizio lo schema biochimico della formazione della melanina. I suoi livelli intramelanocitici, disponibili per la melanogenesi, sono probabilmente controllati, almeno in parte, dalla fenilalanina idrossilasi, un enzima che converte la fenilalanina in tirosina. Dato che l’ipopigmentazione è una delle manifestazioni pleiotropiche della fenilchetonuria, condizione in cui questa attività enzimatica è compromessa, l’ipotesi di un suo ruolo regolativo nella melanogenesi è attentamente al vaglio. I suoi livelli intramelanosomali, vista l’impossibilità di attraversare liberamente il doppio strato lipidico della membrana melanosomale, sono controllati da un trasportatore melanosomale attivo,non ancora individuato.
Candidata a questo ruolo è stata la proteina P, svestita, poi, del quale, da dati biochimici diretti che non mostrano differenze nel trasporto della tirosina tra melanociti normali e melanociti-p. La proteina P risulta essere una proteina integrale della membrana melanosomale, le cui somiglianze strutturali con la proteina antiporto H+/Na+ di E. coli, fanno pensare ad un suo possibile ruolo nella regolazione del pH melanosomale. Come pompa protonica si presterebbe a mantenere neutro il pH all’interno del melanosoma (organello acido), creando l’ambiente ottimale per l’attività della tirosinasi, e, forse, per la formazione di un complesso proteico melanogenico ad alto peso molecolare: TYR-TYRP1-TYRP2.
Altro substrato melanogenico, dalla cui presenza dipende la sintesi della feomelanina, è la cisteina, amminoacido che, come la tirosina, non essendo capace di attraversare liberamente la membrana melanosomale, necessita di un trasportatore attivo, quale ancora non è chiaro, che gli consenta l’ingresso nel melanosoma e, all’occorrenza, quando la via procede verso la sintesi dell’ eumelanina, l’efflusso da esso.
Gli enzimi che regolano le concentrazioni intracellulare e/o intramelanosomale dei composti sulfidrilici potrebbero influenzare la sintesi della melanina, forzando la reazione verso la formazione della feomelanina o dell’eumelanina.
La tirosinasi (TYR) è un enzima avente tre funzioni catalitiche ( tirosina idrossilasi, DOPA ossidasi e DHI/DHICA ossidasi), localizzate, probabilmente, in tre siti distinti. L’attività catalitica più critica è, come abbiamo già visto, l’idrossilazione dell’L-tirosina a DOPA, la cui resa è trascurabile, in assenza della tirosinasi. La stessa reazione presenta una resa trascurabile anche quando, presente la tirosinasi, manca il suo cofattore, il DOPA, prodotto della stessa reazione. E’ probabile che la tirosinasi sia inizialmente attivata da ioni Ferro, così che l’idrossilazione della tirosina porterebbe ad un lento accumulo di DOPA, che raggiunta la concentrazione catalitica richiesta, si sostituirebbe al Ferro come cofattore dell’enzima.
In competizione con la tirosina, come substrato della tirosinasi, sono i residui di tirosina e/o fenilalanina, esposti su qualsiasi polipeptide o proteina, che agirebbero in questo caso come inibitori melanogenici.
Il DOPAchinone rappresenta un punto regolatore chiave, a partire dal quale la via procede verso la sintesi della feomelanina o dell’eumelanina.
In presenza di gruppi sulfidrilici, glutammine e in particolare cisteine, viene prodotta la feomelanina (fig. 7).
La cisteina ( e la glutammina) reagisce stechiometricamente con il DOPAchinone generando cisteinilDOPAs, che, attraverso una serie di reazioni scarsamente note, ciclizzano in un secondo anello di tipo non indolico, formando benzodiazine che polimerizzano in feomelanina.
In assenza, invece, di tali gruppi (o in presenza di essi in quantità irrisorie), il DOPAchinone procede verso la sintesi dell’eumelanina (fig. 2.10).
Da esso si forma spontaneamente il leucoDOPAcromo, che si converte rapidamente in DOPAcromo, altro punto regolatore chiave nella via biosintetica.
Il DOPAcromo decarbossila spontaneamente a 5,6-diidrossiindolo (DHI).
In presenza però di alcuni cationi bivalenti di metalli di transizione (Co++, Mg++, Fe++) e/o dell’enzima DOPAcromo tautomerasi DCT/TYRP2, dal DOPAcromo si forma l’intermedio carbossilato, l’acido 2-carbossi-5,6-diidrossiindolo (DHICA).
Poiché DHI e DHICA non sono interconvertibili, il contenuto carbossilico della melanina viene determinato a livello di questa tappa.
La presenza dell’enzima DOPAcromo tautomerasi e/o dei cationi metallici bivalenti incidono dunque sulla composizione finale delle melanine, DHI-derivate e/o DHICA-derivate, le cui differenze strutturali o funzionali non sono ancora chiare, ma sicuramente si prospettano significative, in quanto le melanine DHI-derivate sono nere e lanuginose, mentre le melanine DHICA-derivate si presentano di un colore marrone-giallastro e finemente disperse.
Alla produzione di DHI e/o DHICA seguono almeno altre due tappe catalitiche. Dall’ossidazione di DHI e DHICA da parte della tirosinasi si formano rispettivamente il 5,6-indolchinone e il 5,6-indolchinone carbossilato.
L’enzima TYRP1 che, nel topo, sostituisce la tirosinasi nell’attività di DHICA ossidasi, sembra che nei melanociti umani abbia la funzione di stabilizzare il complesso enzimatico melanogenico (TYR-TYRP1-TYRP2), aumentando in modo significativo l’attività della tirosinasi.
Questo complesso, la cui formazione, come già detto, sarebbe favorita dal pH melanosomale ottimale mantenuto dalla proteina P, è costituito da tre proteine, i cui geni, derivanti da un gene ancestrale comune, costituiscono la famiglia del gene della tirosinasi umana, a cui appartiene anche TYRL (pseudogene della tirosinasi, non attivo). Esse rivelano una struttura proteica comune, in particolare una regione ricca di cisteina EGF-like (fattore di crescita dell’epidermide), in prossimità dell’estremità ammino-terminale, probabilmente coinvolta nelle interazioni proteine-proteine, concorrenti alla formazione del complesso multimerico, e due domini ricchi di istidina che legano un metallo ( 2 atomi di rame in TYR, 2 di zinco in TYRP2 e 2 di ferro in TYRP1), indicati come probabili siti catalitici, rivolti nel lume melanosomale.
La proteina PMEL17, proteina della matrice strutturale melanosomale, procede infine alla polimerizzazione di DHI ossidato e/o DHICA ossidato ad eumelanina, agendo come scaffold per la deposizione della stessa.
Ancora da identificare sono gli enzimi coinvolti nelle reazioni della via feomelanica.
(Hearing, 1991; King, 2001).
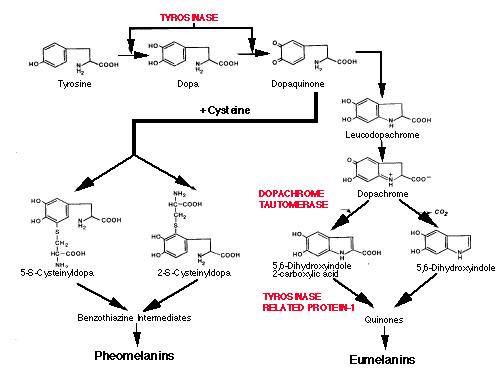
Le prime due tappe, tappe rate-limiting, richiedono la presenza dell’enzima tirosinasi.Il DOPAchinone e il DOPAcromo rappresentano due punti regolatori chiave nella via biosintetica: dal primo si forma la feomelanina o l’eumelanina, dal secondo si formano l’eumelanina decarbossilata e/o carbossilata.Il risultato finale è generalmente una mixed-melanina.Spiegazione nel testo. Da King, Facts about.
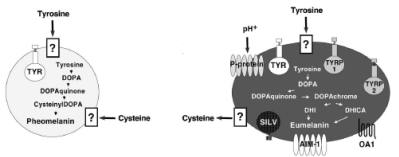
Fig. 7. Apparato melanosomale.
Spiegazione nel testo.Da Sturm, 2001 (modificata- R. Pellegrino, 2007).
Regolazione della melanogenesi.
La regolazione subcellulare della melanogenesi (il flusso della via biosintetica, in relazione all’ambiente melanosomale) è coordinata ed integrata da una più complessa regolazione cellulare, la quale si avvale di svariati fattori, che esercitano il loro controllo a livello trascrizionale, traduzionale e post-traduzionale, positivamente o negativamente, disponendosi in sequenze non lineari, bensì in una rete multidimensionale, in cui agiscono ed interagiscono in un modo nonrandon, determinato dal contesto genetico-biochimico-fisico. Risultato finale di tale “fine tuning” (azione coordinata), è il livello basale costitutivo della melanogenesi (continua nei melanociti epidermici, ciclica nei melanociti follicolari, quasi assente, dopo lo sviluppo fetale, nei melanociti oculari).
Un ruolo importantissimo nella regolazione positiva della melanogenesi (tipo e grado di melanizzazione) è svolto anche nell’uomo, come nel topo, dal sistema “recettore MC1R-agonisti αMSH/ACTH”, attraverso la via del cAMP (fig.8), come confermato da osservazioni in vivo (disturbo di Addison, sindrome di Cushing, fenotipo capelli rossi, ecc.) ed in vitro (melanociti umani coltivati in presenza di αMSH/ACTH o di agenti farmacologici che elevano la quantità di cAMP, quali forscolina (FK), colera tossina (CT) e isobutilmetilxantina (IBMX).
L’aumento della concentrazione intracellulare del cAMP (adenosinmonofosfato ciclico), attraverso l’attivazione dell’adenilato ciclasi (AC), mediata dal recettore MC1R (recettore melanocortino 1), a sua volta attivato dai ligandi agonisti αMSH/ACTH (ormone stimolante il melanocita/ormone adenocorticotropico), coinvolge l’attivazione della proteina cinasi A (PKA) e quindi del fattore di trascrizione CREB (proteina che lega l’elemento di risposta all’AMP ciclico), che, legandosi al dominio consenso CRE (elemento di risposta all’AMP ciclico) del promotore del fattore di trascrizione MITF (il cui CRE è funzionale solo nei melanociti) lo attiva. MITF (fattore di trascrizione della microftalmia), a sua volta, si lega agli elementi consenso E-box ed M-box dei promotori dei geni melanosomali (TYR, TYRP1, TYRP2, OA1, P, PMEL17) e li attiva, aumentando così la loro espressione, che risulta in un aumento della sintesi melanica. Sembra che il legame MITF- MATP (proteina di trasporto associata alla membrana; anche detta AIM1) non sia diretto (Vetrini, 2004) e che TYRP2 possa avvalersi di due processi regolatori in questa via, data la presenza nel suo promotore non solo degli elementi E-box ed M-box per il legame con MITF, ma anche di CRE per l’attivazione diretta da parte di CREB (si avvale forse di quest’ultimo quando si esprime nel RPE di topi Mitf- mutanti? nda, Vetrini, 20004) .L’esistenza di due isoforme di MITF, MITF-M ed MITF-A, presenti l’una nei melanociti derivanti dalla cresta neurale e l’altra nei melanociti derivanti dal neuroectoderma, che differiscono nella sequenza di transattivazione amminoterminale, fa pensare ad una regolazione differenziale della melanogenesi (vedi Beermann, 1990).
Al fattore di trascrizione MITF si affiancano, nella regolazione dell’espressione dei geni melanosomali altri fattori di trascrizione, attivatori o inibitori, come confermato da numerosi elementi consenso presenti nei promotori dei suddetti geni. Lo stesso MITF sembra sia sinergicamente regolato da altri due fattori di trascrizione, PAX3 e SOX10.
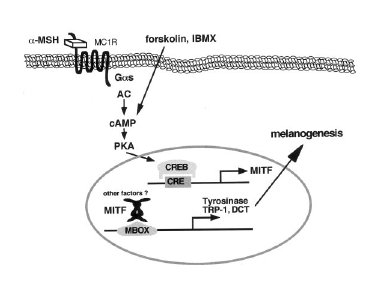
Fig. 8. La via cAMP/PKA.
Il meccanismo di regolazione della melanogenesi indotto dal cAMP coinvolge il fattore di trascrizione associato alla Microftalmia (MITF) come trasduttore del segnale. Spiegazione nel testo.Da Busca, 2000.
Attraverso la via del cAMP viene effettuato anche un controllo a livello post-traduzionale (fig. 9), atto ad evitare una super-produzione di melanina, che potrebbe essere nociva per i melanociti stessi. In questa via , melanocita-specifica, il cAMP attiva una MAP cinasi (MAPK), che fosforica il MITF alla serina 73. Questa fosforilazione determina un aumento dell’attività trascrizionale di MITF ma anche la sua ubiquitinilazione, che promuove il suo trasporto al proteosoma per la degradazione. L’abbassamento del livello di MITF, che ne segue, porta ad una regolazione negativa dell’espressione dei geni melanosomali e quindi ad una inibizione della melanogenesi (Busca, 2000).
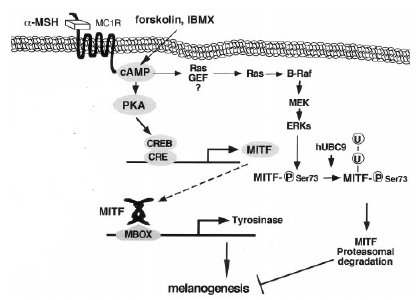
Fig. 9. Le vie cAMP/PKA e cAMP/MAPK.
Controllo trascrizionale di MITF, attraverso la via cAMP/PKA.Controllo post-traduzionale di MITF, attraverso la via cAMP/MAPK.Spiegazione nel testo.Da Busca, 2000 (modificata-R. Pellegrino , 2007).
Studi recenti, eseguiti sui topi nonagouti Pomc -/- (topi transgenici Pomc-KO), che producono eumelanina (mantello nero) nonostante la totale assenza, locale e sistemica, dei ligandi αMSH/ACTH, senza un drastico cambiamento della melanogenesi, come invece atteso, indicano la presenza di una significativa attività costitutiva di MC1R (ligando-indipendente), forse accompagnata da una ridondanza di segnali proeumelanogenici nonmelanocortini presenti nell’ambiente (Slominski, 2004).
Un ruolo negativo nella melanogenesi è invece assunto dalla proteina del segnale aguti (ASP), studiata nei topi aguti, dove nella fase anagena del ciclo di crescita del pelo, presente in piccole quantità, è in grado di promuovere transitoriamente lo switching eumelanina→feomelanina, determinando la comparsa di una banda subapicale gialla in un pelo nero (tipico del mantello aguti). Dati in vitro ed in vivo mostrano che ASP ostacola la via eumelanogenica, inibendo leggermente l’espressione e l’attività della tirosinasi, e quasi totalmente l’espressione e l’attività delle altre proteine melanosomali e di MC1R, e induce lo switching eumelanina→feomelanina (fig. 2.10). Tale proteina esplica la sua funzione antagonizzando i peptici melanocortini (competitivamente e non) attraverso il suo legame allo stesso sito o a siti separati su MC1R (rispettivamente come antagonista e agonista inverso) e coinvolge il fattore MITF.
Comunque il fenotipo leggermente giallo mostrato dai topi aguti Pomc -/- (topi transgenici Pomc-KO) mostra, anche in questo caso, la presenza di un’attività costitutiva di MC1R (Slominski, 2004).
Il ruolo di ASP nella pigmentazione umana non è ancora chiaro, anche se nei melanociti umani coltivati, ASP inibisce la sintesi dell’eumelanina, l’attività della tirosinasi e riduce il livello di espressione di TRP1 e tirosinasi.
Abbronzatura.
In condizioni fisiologiche, le radiazioni ultraviolette (UV) della luce solare, agendo, sia direttamente che indirettamente, sui melanociti, stimolano la melanogenesi, determinando un inscurimento della cute, la cosiddetta abbronzatura, che gioca un ruolo fotoprotettivo chiave contro gli effetti carcinogeni degli UV (fig. 10).
Gli effetti melanogenici diretti risultano dall’azione di messaggeri cellulari: diacilglicerolo (DAG) e la via della proteina cinasi C (PKC), ossido nitrico (NO) e la via della proteina cinasi G (PKG), dimeri di Timidina e gli enzimi di riparo del DNA.
Gli effetti melanogenici indiretti, più rilevanti rispetto ai precedenti e accreditati da un maggior numero di dati, sono dovuti ad un processo di regolazione paracrina che coinvolge i cheratinociti. Queste cellule, in risposta ai raggi ultravioletti, secernono fattori specifici, alcuni dei quali inducono l’attivazione dei melanociti (prostaglandine PGE2, ormoni melanocortini αMSH e ACTH, endotelina-1), mentre altri inattivano la melanogenesi ( interleuchina-1, TNF-a (fattore di necrosi tumorale α, citochina), interferoni e bFGF (fattore di crescita fibroblastico)). E’ l’equilibrio tra questi, a determinare l’abbronzatura (Busca, 2000).
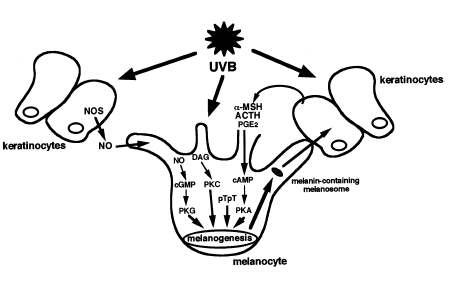
La melanogenesi risulta da un insieme complesso di processi regolatori che coinvolgono gli effetti diretti delle radiazioni UV sui melanociti e gli effetti indiretti delle stesse, attraverso il rilascio di fattori secreti dai cheratinociti.Da Busca, 2000.
MATERIALE DIDATTICO
Albinismo. Fenotipo pigmentario: scarica testo in pdf
Albinismo. Fenotipo pigmentario: scarica slides in pdf
BIBLIOGRAFIA.
Buscar, R., Ballotti, R. Cyclic AMPa key messenger in the regulation of skin pigmentation. Pigment Cell Res. 13; 60-69. 2000. Text .
Hearing, V. J, Tsukamoto, T. Enzymatic control of pigmentation in mammals. FASEB J. 5; 2902-2909. 1991. Full Text (pdf 1,95 MB).
King, R. A., Hearing, V.G., Creel, D.J. and Oetting, W.S. Albinism. Metabolic and Molecular Bases of Inherited Disease, Ed 8. Scriver, C.R., Beaudet, A.L., Sly, W.S., and Valle, D. (eds). McGraw-Hill, New York; 2001. Text (gentilmente fornito da R. King).
Kushimoto, T., Basrur, V. et al. A model for melanosome biogenesis based on the purification and analysis of early melanosomes. PNAS 98; 10698-10703. 2001. Full Text (pdf 548 KB)
Raposo, G. and Marks, M.S. Melanosomes-dark organelles enlighten endosomal membrane transport. Nature Publishing Group. 2007. Text (gentilmente segnalato e fornito da Vincent Hearing).
Slominski, A. et altri. Melanin pigmentation in Mammalian skin and its hormonal regulation. Physiol Rev. 84; 1155-1228. 2003. Full Text (pdf 1.480 KB)
Slominski, A. et altri. Preservation of eumelanin hair pigmentation in proopiomelanocortin-deficient mice on a nonagouti (a7a) genetic background. Endocrinology 146(3): 1245-1253. 2004. Text
Sturm, R. A. et al. Human pigmentation genes : identification, structure and consequences of polymorphic variation. Gene 277; 49-62. 2001. Text.


